Tests IDEXX SDMA
Cas clinique SDMA : Louna
La SDMA, un élément indispensable du bilan rénal complet de routine, qui doit comporter des marqueurs lésionnels et fonctionnels.

Patient :
Louna, chienne épagneul breton entière de 9 ans.
Motif de la consultation :
Vomissements chroniques depuis 1 mois (alimentaires et bileux), amaigrissement important (-6 kg).
Historique :
Aucun antécédent rapporté.
Examen clinique :
Louna est en hypothermie à 36,4°C. Elle est en bon état général et alerte malgré l’amaigrissement constaté. L’examen des appareils cardio-vasculaire et respiratoire ne montre pas d’anomalie. La palpation abdominale est souple et non douloureuse crânialement mais Louna présente un inconfort en région caudale. Aucune adénomégalie n’est à rapporter.
Liste des anomalies :
- Vomissements chroniques
- Amaigrissement
- Inconfort à la palpation abdominale
Hypothèses diagnostiques
Vomissements chroniques > 5 à 7 jours
Syndrome de rétention gastrique
- Corps étranger
- Gastropathie hypertropique pylorique ou “sténose”
- Masse en région de l’antre pylorique
- Gastroparésie
Absence de syndrome de rétention gastrique : Causes digestives
- Intolérance/allergie alimentaire
- Corps étranger
- MICI
- Granulome
- Tumeur digestive
- Lymphangiectasie
- Gastrite/colite/entérite chronique
- Parasites
- Iléus
- Volvulus
- SDTE
- Ulcères
Causes extradigestives
- Pancréatite
- Hépatopathie
- Hypocorticisme
- Tumeur extradigestive
- Déséquilibres ioniques/acido-basiques
- Causes neurologiques
- Maladie rénale (consultation tardive)
- Pyomètre (consultation tardive)
- Diabète sucré (consultation tardive)
Examens complémentaires
Un bilan biologique est réalisé de manière à explorer les principales hypothèses diagnostiques en première intention.
La numération et formule sanguine est utile pour explorer ou exclure des pertes de sang associées à des tumeurs, des lésions digestives ou un corps étranger par exemple, un phénomène inflammatoire/infectieux évident, une anémie secondaire à une maladie rénale avancée, une modification de formule associée à un hypocorticisme… La NFS révèle la présence d’une anémie normocytaire normochrome arégénérative associée à une neutrophilie modérée et une thrombocytose. L’image en « aileron de requin » sur les nuages de points (cf flèche sur le graphique) permet de suspecter la présence de neutrophiles immatures (band cells) ou toxiques. Le frottis sanguin révèle la présence de rares sphérocytes et de neutrophiles au cytoplasme spumeux. Une hypothèse inflammatoire est donc privilégiée à ce stade.
Le bilan biochimique est quant à lui utile pour explorer les hypothèses digestives, rénales ainsi que les dysendocrinies notamment. Le bilan biochimique réalisé à la clinique révèle une hypoprotidémie et une hypoalbuminémie sévère. L’hypoalbuminémie peut avoir plusieurs origines : une augmentation des pertes (rénales, digestives, hémorragies, épanchements), une diminution de la synthèse hépatique (insuffisance hépatique sévère), un défaut d’apport (malnutrition, maldigestion, malabsorption), une hémodilution ou un processus inflammatoire notamment. Les fructosamines étant des protéines, elles sont elles aussi impactées et sont inférieures à l’intervalle de référence. Le défaut d’apport et l’hémodilution sont écartés d’emblée compte tenu de l’absence de commémoratifs en faveur de ces hypothèses. L’interprétation combinée des protéines totales associées à l’hématocrite et les caractéristiques de l’anémie (non régénérative) n’orientent pas vers une perte de sang. L’interprétation combinée de la glycémie et des fructosamines permet d’exclure le diabète sucré. Les paramètres hépatiques (cholestérol, bilirubine, urée, glucose) étant dans l’intervalle de référence, l’hypothèse d’insuffisance hépatique sévère n’est pas retenue à ce stade. Le bilan hépatique complet n’oriente pas vers une hépatopathie (augmentation des ALAT non significative). Les paramètres rénaux classiquement utilisés (urée, créatinine, phosphore, ionogramme) sont tout d’abord dans les normes sur le bilan réalisé à la clinique, puis sont au-dessus de l’intervalle de référence sur le bilan rénal complet incluant la SDMA. Une valeur de 38 μg/dL oriente de façon évidente vers une baisse du débit de filtration glomérulaire associée à une insuffisance rénale sévère. La lipase spécifique du pancréas est située dans la zone grise, la pancréatite ne peut être confirmée et ce malgré une amylasémie légèrement supérieure à l’intervalle de référence. Un contrôle sous 15 jours est vivement conseillé. On observe une hypocalcémie et une hypomagnésémie pouvant être expliquées par l’hypoprotidémie totale (baisse de la fraction liée aux protéines). Le reste du bilan ionique et le rapport Na/K ne sont pas en faveur de l’hypocorticisme (Na/K>27).
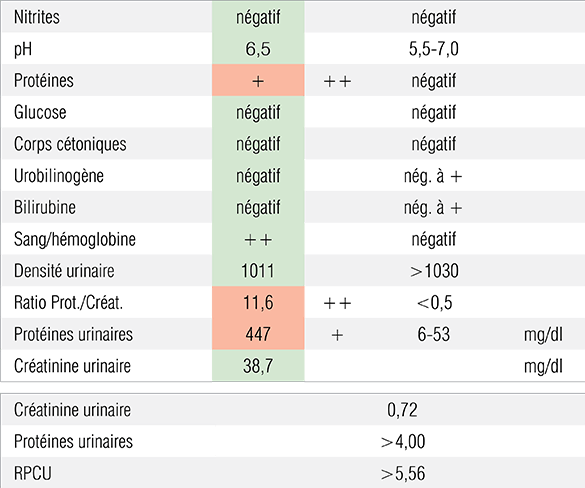
Conformément au protocole DPS (Dépister - Prendre en charge - Suivre), une analyse urinaire complète a été réalisée (prélèvement par cystocentèse). Elle révèle la présence de protéines et de sang dans les urines. Cette dernière anomalie pourrait être expliquée par la méthode de collecte des urines. En revanche, la densité urinaire étant abaissée à 1,011, la protéinurie peut être considérée comme significative. Un RPCU (Rapport Protéine/Créatinine Urinaire) a donc été réalisé pour confirmer et quantifier la protéinurie. Le RPCU très nettement augmenté (11,6 puis >5,56) révèle la présence d’une protéinurie significative avec azotémie. Plusieurs contrôles ont été effectués afin de s’assurer de la persistance de cette protéinurie au cours du temps. D’après le consensus ACVIM, une protéinurie est considérée comme persistante si elle est mise en évidence à 3 occasions ou plus à 2 semaines d’intervalle.
Une différence de > 40% entre 2 valeurs est considérée comme significative dans le cadre du suivi du RPCU.
Le caractère pathologique de cette protéinurie est confirmé ici en l’absence de fièvre, d’exercice intense ou de crises convulsives.
L’hypothèse de protéinurie pré-rénale ayant été en partie écartée (TP/NFS normales), l’exploration s’est concentrée sur les causes de protéinuries rénales (glomérulaires, tubulaires) et post-rénales (inflammation, urolithiase, tumeur, infection).
La plupart des hypothèses post-rénales ont été exclues suite à la réalisation d’un ECBU. Les protéinuries glomérulaires peuvent avoir plusieurs causes parmi lesquelles on peut citer des causes infectieuses (Lyme, pyélonéphrite, piroplasmose, leishmaniose, ehrlichiose, dirofilariose, septicémie, pyodermite, mycoplasmose), inflammatoires (MICI, pancréatite, cholangite, polyarthrite, lupus, maladies à médiation immune), endocriniennes (hyperadrénocorticisme), médicamenteuses (glucocorticoïdes, sulfamides/triméthoprime), tumorales (leucémie, lymphome, carcinomes, mastocytome, histiocytose maligne), familiales/congénitales (amyloïdose, néphrite héréditaire, glomérulonéphrite,
glomérulosclérose, polykystose rénale). L’absence de glucosurie était en défaveur de l’hypothèse de tubulopathie. Compte-tenu des nombreux indices orientant vers une inflammation et de l’ampleur de la protéinurie, une biopsie rénale a été proposée et acceptée par le propriétaire.
Afin de vérifier l’absence de contre-indications à la réalisation de cette biopsie et l’absence de complications liées à la fuite massive de protéines par le filtre rénal, un bilan de coagulation a été réalisé au laboratoire de référence. Celui-ci a permis de mettre en évidence un déficit en antithrombine III créant ainsi un état d’hypercoagulabilité permanent dont les conséquences peuvent être dramatiques.
A l’examen échographique, on observe une microhépathie sans anomalie majeure du parenchyme hépatique ainsi qu’un épaississement de l’estomac compatible avec une gastrite importante. Le reste de l’examen de révèle aucune autre anomalie. Des biopsies digestives et rénales sont effectuées après prise en charge de l’état d’hypercoagulabilité engendré par la fuite d’antithrombine III.
L’examen histologique permet de confirmer que les lésions observées au niveau de l’estomac ne peuvent être à l’origine des vomissements. On note la présence de dépôts de substance amyloïde au sein du parenchyme rénal et plus précisément des glomérules.
Rapports du patient

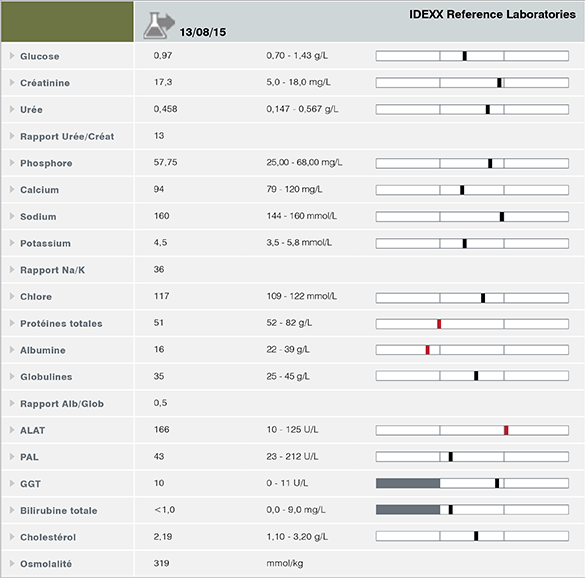
Bilan sanguin complet - Laboratoire de référence
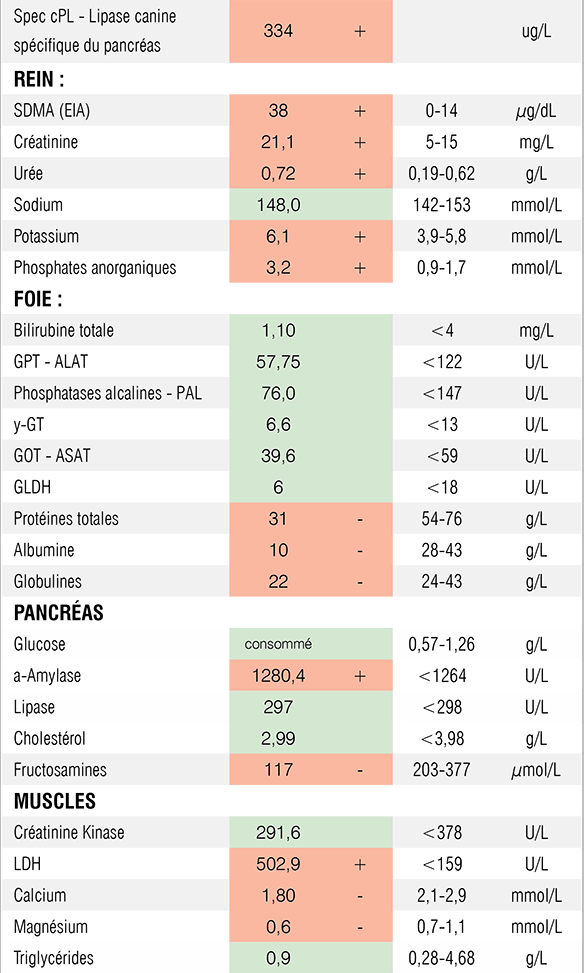
Biochimie urinaire
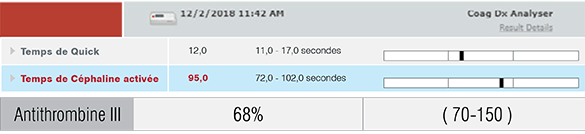
Diagnostic
L’association d’une hypoprotidémie caractérisée par une hypoalbuminémie sévère et d’une protéinurie massive permet de conclure à un syndrome néphrotique partiel (mais la définition stricte lui associe une hypercholestérolémie qui est absente ici).
Louna souffre d’une glomérulopathie dont l’origine est une amyloïdose rénale marquée associée à une néphrite interstitielle légère lymphoplasmocytaire. Cette amyloïdose peut être secondaire à une affection inflammatoire chronique (gastrite ? pancréatite ? autre ?). Malheureusement, le pronostic est très sombre en présence d’une protéinurie massive persistante (augmentation de la fréquence des crises urémiques, de la rapidité de progression de la MRC, du taux de mortalité JACOB F et all, JAVMA 2005 ; 226 : 393 ; HARLEY 2012). Le risque de complications lié à l’état d’hypercoagulabilité avéré péjore encore le pronostic.
Traitement et suivi
Un traitement à base d’antivomitif, anti-acide, orexigène a été instauré pour lutter contre les désordres digestifs. Pour limiter les risques d’accidents thrombo-emboliques, un traitement à base d’aspirine a été prescrit. Concernant la protéinurie, l’objectif est alors de la diminuer de plus de 50% chez le chien (niveau le plus bas possible). Il faut bien sûr traiter la cause en parallèle quand elle a pu être identifiée. Un traitement préventif à base de colchicine (antigoutteux) sensé inhiber la formation de substance amyloïde a été proposé au propriétaire. Un suivi mensuel est conseillé a minima pour contrôler la fonction rénale, le bilan protéique, la protéinurie et anticiper l’apparition d’éventuelles complications.
Sur un patient stable, les contrôles peuvent être réalisés tous les 3 à 6 mois. Malheureusement le suivi n’a pu être poursuivi, Louna étant décédée subitement.
Discussion
Ce cas clinique illustre l’intérêt de réaliser :
- d’une part un bilan rénal complet de manière à mettre en évidence et à quantifier précisément les lésions rénales et ses éventuelles répercussions sur le fonctionnement rénal
- d’autre part un bilan biologique complet pour identifier l’origine de la glomérulopathie.
Ici, l’origine de la glomérulopathie a pu être identifiée :
Louna souffrait d’amyloïdose rénale.
En l’absence d’amélioration de la protéinurie, des lésions interstitielles et tubulaires apparaissent. L’hypothèse est que la
protéinurie contribue à la progression des dommages rénaux en provoquant une inflammation interstitielle et une fibrose autour des tubules rénaux. A terme, l’azotémie s’installe et avec elle l’insuffisance rénale comme c’est le cas pour Louna. Le bilan biologique global permet quant à lui d’explorer et d’exclure en première intention les hypothèses diagnostiques prioritaires et de mettre en évidence d’éventuelles causes sous-jacentes, affections concomitantes et complications.
Conclusion
La glomérulopathie provoquée par l’amyloïdose rénale de Louna a engendré une fuite protéique massive à l’origine d’une
hypoalbuminémie. Une insuffisance rénale s’est installée progressivement. Cliniquement cela s’est traduit par l’apparition d’une azotémie, une hausse de la SDMA et des signes cliniques associés (vomissements).

Frédérique BERNAERTS
DMV, Dipl ECVIM, spécialiste en Médecine Interne
Centre Hospitalier Vétérinaire NORDVET
La Madeleine (59)

Damien LEGROUX
DMV, CES de Biochimie et Hématologie Cliniques Animales.
DU d’hématologie Laboratoire IDEXX
Références bibliographiques
- Proteinuria in dogs and cats. Leyenda Harley, Cathy Langston
Can Vet J 2012 : 53 : 631-638 - Protein-Losing Nephropathy Jill Brunker Compendium article September 2005
- Assessment and Management of Proteinuria in Dogs and Cats : 2004 ACVIM Forum Consensus Statement (Small Animal)
George E. Lees et all
JVIM 2005 ; 19 : 377-385 - Evaluation of the association between initial proteinuria and morbidity rate or death in dogs with naturally occurring chronic renal failure
Jacob F et al
JAVMA 2005 ; 226:393 - Diagnostic et traitement du syndrome néphrotique
GOUJON I
Le point vétérinaire n245 Mai 2004 - Amyloïdose rénale, les étapes du diagnostic
TARONI M., POUZOT-NEVORET C.
L’essentiel n321, Février 2014